本土药企久苦“重复检查”,中国加入PIC/S会有哪些改变
在谈及帮助国产创新药“出海”东南亚的经历时,艾社康国际合作部高级总监顾蕊告诉第一财经,中国制药企业往往苦恼于三个问题:一是临床研究阶段药品是否具有国际多中心试验数据;二是药品是否已经在欧美成熟的药品监管机构获批并上市;三是生产阶段企业的生产线是否“过认证关”,也即是否获得PIC/S成员国的GMP认证。
PIC/S,全称为国际药品检查合作计划(Pharmaceutical Inspection Co-operation Scheme),是国际药品检查领域的权威机构。国产药尤其是仿制药和基本药物,要想在日趋激烈的全球竞争中占据一席之地,基本条件之一就是药品质量和生产安全获国际市场的广泛认可。
GMP是药品生产和质量管理的基本准则,我国自“十二五”期间就对药品生产企业强制实施了新版GMP,但由于尚未获得PIC/S背书,与大多数出口国尤其是发达和重要的发展中国家尚未达成互认,国产药在出海前往往需要获得PIC/S成员国,如美国FDA、欧洲EMA等的GMP证书。
“这是一笔不小的开销。”一名企业界人士告诉记者。
而今,这一困扰中国跨国制药企业的掣肘难题有望在未来几年里加速破局。据国际药品检查组织6月中旬最新通报,当前中国已经完成预申请阶段工作。
“我们正在积极申请正式加入PIC/S,开展了GMP对标评估等工作,通过对标评估,我们认为中国药品GMP的要求基本等同于欧盟、世界卫生组织药品GMP以及ICH Q7要求。”国家药监局官网近日在一份对人大代表的建议答复中如是提到。
多名受访业界人士认为,近年来,随着中国头部医药企业国际化意愿越来越强,不少企业已达到国际生产质量要求。中国加入PIC/S,有利于减轻这些企业的出海成本,推动国产药在海外的商业化步伐,也将是对我国药品监管体系与国际接轨的一次有利证明。但由于PIC/S的高准入门槛,中国的药品监管和检查体系在未来五六年间,还有较大提升空间。
耗时多年的预申请
国家药监局副局长赵军宁7月初在国新办举办的新闻发布会上说,国家药监局已经加入了国际人用药品技术协调会(ICH)、医疗器械监管机构论坛(IMDRF)、全球医疗器械法规协调会(GHWP)等组织,预申请加入PIC/S,为产业高质量发展营造良好国际环境。
回顾来看,在前述医药器械类国际监管合作组织中,中国加入PIC/S的过程显得相对漫长。
2012年12月底,食药监等四部委联合发文提出,对已经通过世界卫生组织或PIC/S成员单位药品GMP认证检查的企业或其他基础较好、质量保证体系完善、既往药品GMP认证检查中未发现严重缺陷项目的企业,通过优先安排检查等措施,鼓励其全部生产线一次性通过认证。
2017年6月,中国以第八个监管机构成员的身份加入了ICH。从2018年9月开始,国家药监局和PIC/S总部历经了7轮谈判,最终在2021年9月正式致函PIC/S,申请启动预加入程序。
今年6月16日,PIC/S通报中国国家药监局申请加入该组织的最新工作进展,当前我国已经完成预申请阶段工作。
同样涉及药品监管体系的国际互认,相较于关于临床研发的ICH,在生产监管方面中国加入PIC/S的步伐为何较缓?
“事实上,从刚开始申请的时候,无论是ICH还是PIC/S,药监部门都是同等高度重视的。”北京大学公共卫生学院全球卫生学院主任、全球健康发展研究院副院长许铭在接受第一财经采访时称。
2016年,许铭曾作为“对药监局加入PIC/S的可行性研究”课题组的项目负责人之一,开启了对药监部门和产业界两方向的调研。他认为,PIC/S进展虽然相对慢了,但“好事件不论早晚”,只要最终能来,对于行业就是利好。
顾蕊同样表示,从决定是否递交PIC/S预认证申请,到完成预认证,再到进入正式申请流程,每一步都不简单。根据他国历史经验,预认证最长需要2年,正式加入则另需5~6年。目前,中国PIC/S预认证获批的速度快于业界预期,后续申请工作能否也加快一些,业界对此也报以期待,但也不应过分高估这一进程。
“申请加入PIC/S,就意味着需要做好对国内整个药品生产体系进行全面梳理的准备,加入PIC/S则意味着中国在GMP标准、指南和培训监管等方面要求均与国际先进水平相接轨。此外,PIC/S秘书处的评估工作还可能会有更多权衡因素,而PIC/S的标准也可能会根据全球药品监管的新动向和新趋势进行更新调整。”顾蕊说。
“国产药出海可以少花钱”
许铭认为,随着药品全球流通加速以及全球药品供应链的复杂化趋势,各国均面临进口产品数量增长但检查资源有限的挑战。如何在确保进口药品质量和安全性的前提下,避免重复检查,尽快让药品走向市场?现场检查结果互认因此成为一种趋势。
“虽然加入PIC/S也并不意味着中国之后就可以直接和其他国家进行GMP互认,但这为后续签订双边或多边互认协议奠定了基础。”许铭说。
中国之外,在东亚、东南亚地区,印度等国近年来也在朝着PIC/S成员国方向努力。而新加坡、马来西亚、印度尼西亚等国已正式加入PIC/S。
顾蕊认为,每个申请加入PIC/S的国家动机或存在差异。比如,新加坡、马来西亚等东南亚国家,当地医疗健康市场供小于求,申请加入PIC/S则更多是为了让国际药企进入当地市场。而中国或更关注于打通国产仿制药和原研创新药出口的“关卡”。
“中国通过加入PIC/S与其他国家的GMP接轨和达成互认,虽然称不上是药品出海成败的决定性因素,但也是药物出口的重要环节,关乎创新药企的出海成本,也关乎原料药、仿制药能否更及时地占领更多的国际市场。总体而言,中国加入PIC/S对中国医药产业的国际化发展意义重大。”顾蕊说。
她解释称,一直以来,由于中国未加入PIC/S,国产药在出口前,出口目的地国家往往会派出去往药品的生产厂进行现场检查。在此背景下,一些药企在出口前或面临按照进口国标准重新设计改造GMP厂房车间的压力。
即便是药品生产标准已达到国际领先水平的头部制药企业,也同样面临重复检查、上市进展减缓、成本压力增大等困扰。
许铭举例称,目前,国产药出海几乎无法规避的一步就是取得PIC/S成员国的GMP认证,比如获得美国FDA的c-GMP认证。首先,FDA派遣检察员对药品生产现场进行检查,企业需要承担经费支出。几年前,企业要维持FDA的c-GMP资质,年均费用就已达到了20多万美元,对于希望通过FDA相关认证的中国企业而言也意味着不小的成本开支。其次,药品出口还面临重复检查,这将进一步影响企业走出去的速度。
“尤其是在三年新冠疫情期间,因为人员跨国流通不便,一些创新药企业的出海步伐不得不放缓,甚至被迫中断。”顾蕊说。
推动中国GMP体系与国际接轨
顾蕊认为,不同于与创新药出海关系更密切的ICH,加入国可采取“先达到基本标准,加入后再逐步消化相关规定,并选择性地纳入本国监管体系”的策略,要想加入PIC/S,大概率需要“中国的GMP先与国际标准接轨,再在加入后不断完善”。
2017~2018年期间,国家食品药品审核查验中心曾在比尔·盖茨基金项目的支持下,聘请5位国际药品检查专家参照PIC/S评估指标体系先后对江苏、山东、河南和上海等15个省级单位药品检查机构GMP检查体系开展评估工作。彼时总结的问题主要包括:各省承担所在地的监管职责,省级专业化检察员数量与医药产业规模不匹配、专职化程度不高等。如今,上述问题依然存在。
而在加入PIC/S后,按照PIC/S的高标准和要求,许铭表示,我国GMP检查管理体系建设和整体能力提升还将进一步完善。“只有当监管能力与国际接轨,我国才能更好推动医药贸易的发展,这也是贸易便利化的关键一环。”
此外,在多名业界人士看来,目前,以欧美为代表的中国医药贸易重要出口市场纷纷加大了对海外药品的监管力度,这或将倒逼国内药品监管体系尽快与国际发达水平接轨。
“2022年3月,美国国会要求FDA开展增加对海外药品生产现场检查的试点计划。2023年,FDA可能恢复部分海外现场检查工作。这对中国原料药及制剂扩大对美国出口既是机遇,更是挑战。”中国医药保健品进出口商会会长周惠日前在接受媒体采访时称。
“国际化的医药产业需要国际化的监管机制。”艾社康亚洲创始人兼CEO刘畅对记者表示,过去十来,中国生命科学产业的国际化趋势正盛,无论是CRO企业还是制药企业以及其他相关服务性企业,都已具有与国际先进水平接轨的出海动力和实力,但由于整体的行业生产标准没有拉齐,中国还不是PIC/S的成员国,导致额外付出了一定的时间和经济成本。如果中国建立起相匹配的、高水平的检查能力,可以助推整个生命科学产业链的国际化进程。
许铭同样认为,我国制药企业实施GMP多年,在技术上有了相应的储备,当下,行业层面聚焦的重点是如何让医药外贸更好流通起来,并发挥GMP认证的作用。目前,因为各国GMP认证标准不一,当一国加入PIC/S,可以让该国药企出海少花钱,并且让有限的检查资源更好配置,对于药品进口监管真正做到“好刀用在刀刃上”。
根据PIC/S规定,正式申请的有效期为6年。在未来相当长的一段申请期内,受访业界人士认为,为推动本土药企和监管体系国际化,无论是自下而上,还是自上而下,都需要做更多改变。
许铭说,中国制药企业众多,在全国范围内全面提升产品质量管理体系非一日之功。对此,应从企业自身竞争提升入手,对标国际,自下而上、由点及面地推进。一方面,药企以及从事国际贸易或者推动产品国际化的服务类企业均应当对PIC/S予以更多关注。另一方面,由于要想达到PIC/S标准,企业在生产线上投入的成本较大,地方政府可以在药品招标、医保谈判等环节,对获PIC/S认证的产品予以一定的优先权。
至于进一步促进本土药企的国际化和创新药出海,顾蕊则认为,“从政府支持角度而言,仅药监部门付出努力是不够的。业界期待在政策层面上,对于药品的国际合作,有一个更高级别、协同推动的机制。”
黑龙江桦南县“11·6”悦城体育俱乐部屋顶坍塌事故最新进展:11名重点人员被采取强制措施
目前,当地市县两级纪委监委正在开展调查工作。11月6日,黑龙江佳木斯桦南县悦城体育俱乐部发生部分坍塌,事故造成3人死亡。总台记者在“11·6”悦城体育俱乐部屋顶坍塌事故处置工作领导小组了解到,警方已对以吴某迁为首的涉嫌造成此次坍塌事故的11名重点人员,采取了强制措施。目前,当地市县两级纪委监委正在开展调查工作。事故调查组相关负责人表示,此次事故无论涉及到谁,坚决一查到底、绝不姑息。0000韩国西部海域延坪岛向居民下达躲避令
5日,据仁川市瓮津郡延坪面事务所透露,该事务所于当天中午12时2分和12时30分两次向延坪岛居民下达了躲避令。当地时间5日,位于韩国西部海域北端的延坪岛向当地居民下达了躲避令。5日,据仁川市瓮津郡延坪面事务所透露,该事务所于当天中午12时2分和12时30分两次向延坪岛居民下达了躲避令。延坪面事务所接到军队方面的要求,播放广播称:“当天15时将进行炮击训练,请躲避到避难所。”引导居民躲避。0000中国太保管理层平稳交接 七年奔跑成就“稳进之路”
薪火相传,生生不息。作为我国第一家全国性股份制商业保险公司,32岁的中国太保集团即将迎来新一轮管理层交接:中国太保董事长孔庆伟年满63岁,即将到龄退休;中国太保总裁傅帆接棒出任集团党委书记,并有望接任董事长;同时,成长于太保、两年前调任海通证券党委副书记的赵永刚重回太保,担任集团党委副书记,并有望接任总经理。0000成都加入“松绑楼市限购”,9月已有11个省会城市调整政策
从6月份开始,成都楼市进入下行通道。截至8月,成交面积降至128万平方米,环比下降20%。又一个省会城市调整住房限购政策,成都加入了进来。截至目前,9月以来,已经有11个省会城市完全取消或者调整住房限购政策。9月26日,成都住建局发布了成都市房地产市场平稳健康发展领导小组办公室印发的《关于进一步优化政策措施促进房地产市场平稳健康发展的通知》(《通知》)。锤子财富2023-09-26 21:17:420001再现百亿基金经理“瘦身”,中欧葛兰、周蔚文卸任部分产品管理
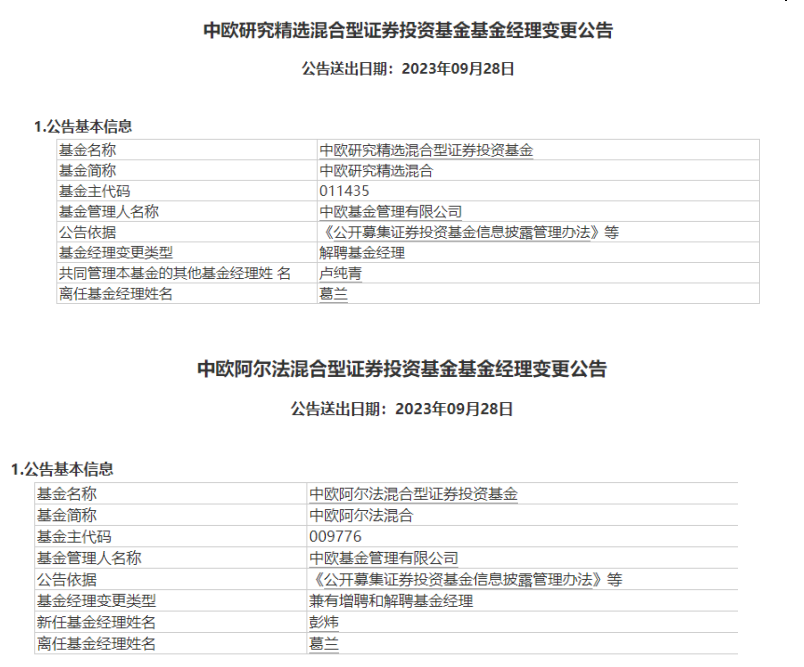
公募“去明星化”已渐成趋势。明星基金经理的最新动向总是备受市场关注。9月28日晚间,中欧基金节前连发三条基金经理变更公告,其中包括明星基金经理葛兰、周蔚文。锤子财富2023-09-28 22:23:160000