一波三折后,国产PD-1抗癌药海外上市步伐终于近了
国产PD-1抗癌药海外上市步伐终于近了。
7月23日傍晚,百济神州(BGNE.NS、06160.HK、688235.SH)发布公告称,欧洲药品管理局人用药品委员会(CHMP)发布其推荐替雷利珠单抗注射液获得上市许可的积极意见,建议批准替雷利珠单抗注射液单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)成人患者。
百济神州方面表示,获得CHMP的积极意见,使得替雷利珠单抗有望获得批准并为ESCC成人患者带来新的治疗。
这意味着,距离替雷利珠单抗在欧盟上市,仅差“临门一脚”了。百济神州内部人士对第一财经记者表示,获得CHMP的积极意见后,还要等欧洲药品管理局给出的最终审议意见。
百济神州的替雷利珠单抗注射液属于国产PD-1抗癌药。
作为率先获批上市的癌症免疫疗法,PD-(L)1检查点抑制剂引领了癌症治疗的变革,但行业现如今“内卷”严重。单单在中国市场,包括双抗在内,就有10款PD-1获批上市,其中,8款是国产药。对于国产企业而言,如果只局限在中国市场竞争的话,获得的市场份额很有限。百济神州的替雷利珠单抗虽说是国产PD-1中销售额最高的,但2022年的销售额也只有28.59亿元。而在全球市场上市的默沙东帕博利珠单抗(K药),全球销售额2022年就已突破200亿美元。因此,国产企业要追求更大市场份额,就需要拓展海外市场。
然而,在过去的2022年,国产PD-1企业出海相继遭遇一些波折。

2022年3月,美国FDA就拒绝了信达生物的信迪利单抗用于非鳞状非小细胞肺癌患者一线治疗,原因在于,FDA认为单一国家数据难以支持新药在美国人群中的疗效和安全性评估;另外信迪利单抗需证明相较于现今非小细胞肺癌一线标准疗法K药具有临床意义。这被业界解读成为是PD-1“出海”难度升级信号。
与此同时,在这一年里,君实生物与百济神州这两家公司的PD-1美国上市申请计划也相继被延迟,原因皆是FDA因旅行限制无法如期在中国完成所需的现场核查工作。
不过,进入到2023年,国产PD-1海外上市进程又有了新进展。
如君实生物在今年5月份投资者交流会上透露称,其PD-1特瑞普利单抗已顺利完成了美国FDA的生产基地的许可前检查。公司合作伙伴Coherus正在准备特瑞普利单抗在美国商业化的相关工作。
百济神州在7月18日举办的投资者研发日活动上表示,其替雷利珠单抗已结束了美国FDA的GMP(药品生产质量管理规范)审查,公司方面希望可以尽快完成接下来的审查进程。
今年会不会成为国产PD-1海外上市元年?值得观察。
收盘丨沪指涨0.39%,大消费板块回暖
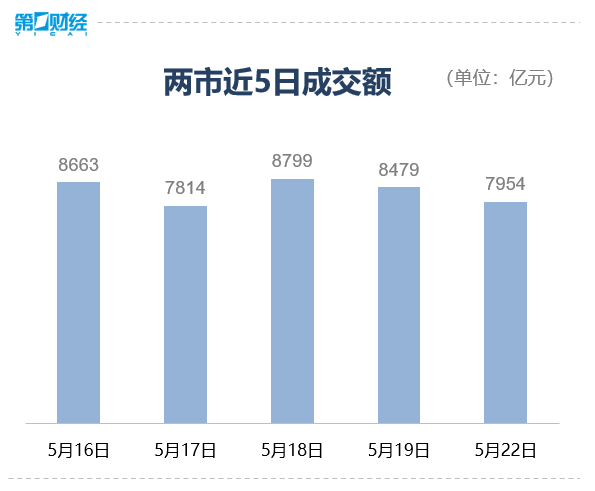
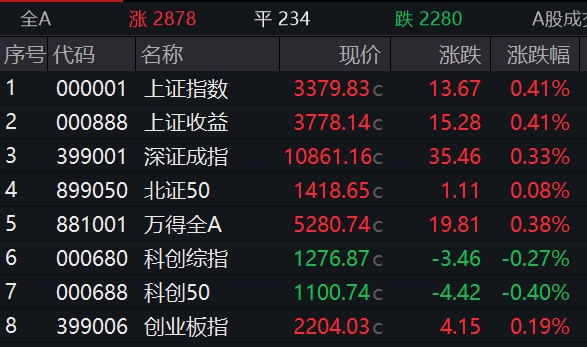
市场仍有震荡整理的需求,但中长期看,市场走势依然看好。5月22日,A股三大指数窄幅震荡,截至收盘,沪指涨0.39%,深成指涨0.32%,创业板指涨0.07%。盘面上看,大消费板块回暖,酒店餐饮、白酒、家电等子板块强势。虚拟电厂、农业种植、物流等板块涨幅居前,教育、网络游戏、传媒、房地产开发等板块跌幅居前。锤子财富2023-05-22 15:37:420000滚动更新丨美股三大指数全线低开,英伟达跌超12%
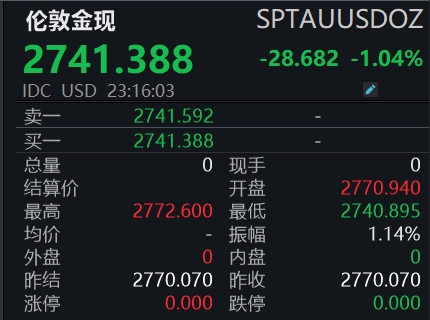
芯片股重挫,英伟达跌超12%,博通、台积电跌超11%。23:31美国1月达拉斯联储商业活动指数为14.1美国1月达拉斯联储商业活动指数为14.1,创2021年10月以来新高,前值由3.4修正为4.5。23:16现货黄金日内跌超1%现货黄金短线下挫,日内跌超1%,现报2741.38美元/盎司。22:43美股芯片股重挫锤子财富2025-02-17 00:52:240000博鳌亚洲论坛2024年年会今天举行开幕会
中国经济展望分论坛,汇集了多位国内外知名专家学者,将围绕中国经济下阶段增长前景、实现中国式现代化,未来如何发力等议题进行深入探讨。今天(3月28日),博鳌亚洲论坛2024年年会将举行开幕大会。多场分论坛、对话会等活动也将于今天举行。0000国产大型水陆两栖飞机AG600完成高温高湿试验
高温高湿试飞是AG600型号合格审定试飞项目中一个重要的科目,验证了飞机在高温高湿严酷环境条件下的系统功能和性能。记者从中国航空工业集团了解到,7月16日,我国自主研制的大型水陆两栖飞机AG600完成了高温高湿飞行试验。0000