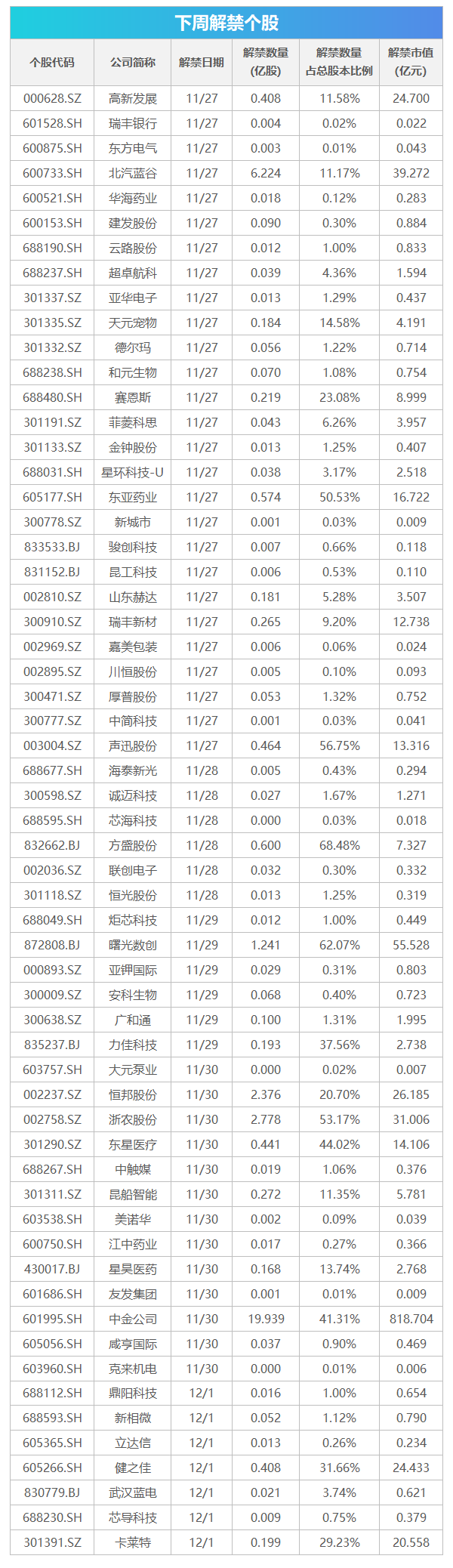
重磅|美国FDA批准首个基因编辑疗法,定价220万美元
当地时间12月8日,美国食品和药物管理局(FDA)批准了该国首个基因编辑治疗药物Casgevy,这也是基因编辑治疗历史上的里程碑事件,距离CRISPR基因编辑技术诞生大约十年,代表着一项重大的科学进步可以让数以万计的患者受益。
Casgevy由制药公司Vertex Pharmaceuticals和生物技术公司CRISPR Therapeutics共同开发,用于治疗12岁及以上成人镰状细胞病。CRISPR Therapeutics由诺贝尔奖获得者Emmanuelle Charpentier创立,该疗法上个月获得了英国监管机构的批准。
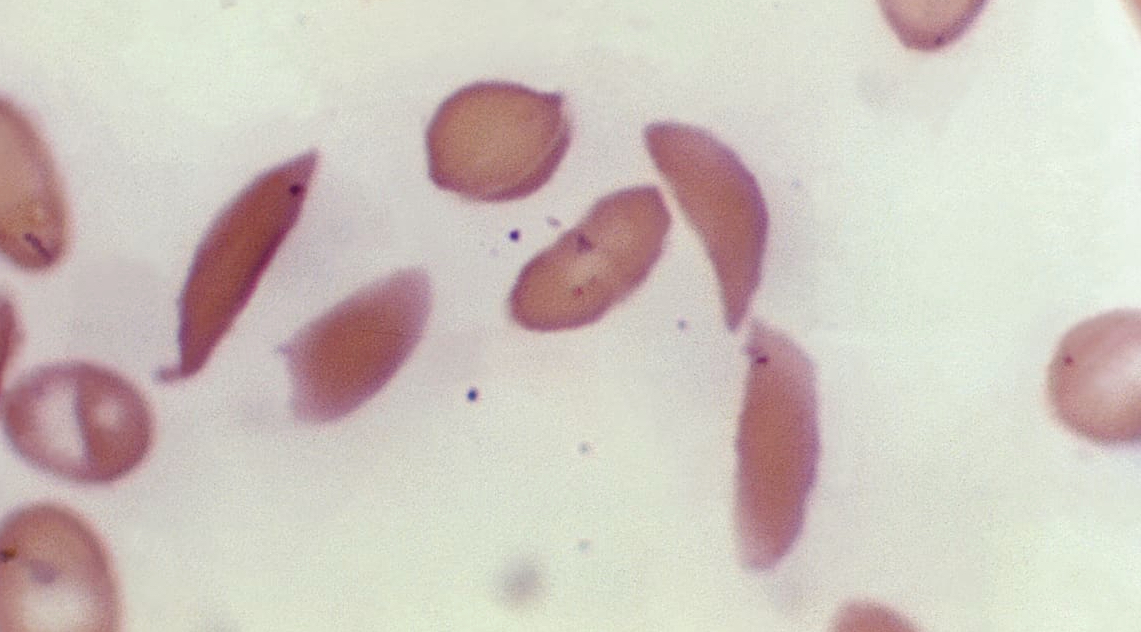
一次治疗,终生治愈
镰状细胞病是一种遗传性血液疾病,基因突变导致通常满月形的红细胞形成半月形卡在血管内,限制血液流动并引起阵阵剧痛。
“镰状细胞病是一种罕见的、使人衰弱且危及生命的血液疾病,其需求未得到满足,我们很高兴能够推动这一领域的发展,特别是对于生活受到该疾病严重干扰的个人而言,”美国FDA生物制品评估和研究中心治疗产品办公室在一份声明中表示。
但这种药物的定价也非常昂贵,每位患者的治疗费用高达220万美元。根据Vertex目前的药物制备能力,大约16000名镰状细胞重症患者将有资格获得该药物。
尽管这种基因编辑治疗只需进行一次,但整个准备过程需要耗费数月时间。具体来看,患者的血液干细胞首先需要被提取和分离,并送往Vertex实验室进行基因改造。但基因编辑好之后,患者需要接受几天的化疗,以清除旧细胞并为新细胞腾出空间。 新细胞被注入后,接受者需要在医院度过数周的时间进行康复。
Vertex公司CEO Reshma Kewalramani表示:“我们相信药品的价格能够反映其带来的价值,而这种价值所带来的价值是一次性疗法,可能终生治愈疾病。”
与此同时,蓝鸟公司(Bluebird Bio)的一款基因疗法Lyfgenia当天也获得了美国FDA批准,用于治疗12岁及以上人群的镰状细胞病,每位患者的治疗费用更是高达310万美元。
2012年,两位女性科学家Jennifer Doudna和Emmanuelle Charpentier发表了关于名为CRISPR-Cas9的基因编辑系统的开创性论文,她们随后因此获得诺贝尔奖。
这一发现引发了众多公司纷纷寻求利用CRISPR基因编辑技术来治疗各种疾病,镰状细胞病成为主要目标。通过CRISPR技术对患者基因进行编辑,可以激活所谓的“胎儿血红蛋白”,以帮助红细胞保持健康的形状。
中国基因编辑疗法进展如何?
在中国,研究人员也瞄准利用CRISPR技术开发药物,从而治疗包括地中海贫血、镰状细胞病在内的遗传性疾病。第一财经记者梳理公开资料,目前有博雅辑因、绑耀生物、本导基因、瑞风生物以及中因科技等多家国内生物技术公司在从事基因编辑疗法产品的开发,并已有多个产品进入临床试验阶段。其中,输血依赖型β地中海贫血是热门的目标;此外,基因变异导致的视网膜色素变性疾病也是一个方向。以输血依赖型β-地中海贫血为例,国内中重度患者人数达30万人。
不过基因编辑药物的开发也面临伦理风险。事实上,早在2015年4月,中山大学黄军就教授发表全球第一篇使用CRISPR/cas9基因编辑技术对人类胚胎中地中海贫血症致病基因修饰的研究成果,但被指挑战了伦理边界。
对此,中国科学院院士、复旦大学附属中山医院心内科主任葛均波教授表示:“我认为,医学可以有疯狂的想法,但是应该拒绝疯狂的行为。”
此外,国内企业在基因编辑疗法技术方面仍然存在进步空间。基因编辑技术难度高,以往模仿分子结构式、绕过化合物专利的路径失灵,需要有更多原创思维。
在安全性方面,相较于体外基因编辑可以通过质量控制来掌控进入人体的编辑产物,体内基因编辑无法进行类似的质量控制,若出现脱靶事件,错误编辑的细胞仍会留在体内。
在支付方面,基因编辑疗法价格高昂,在中国也面临一定的挑战。清华大学药学院创院院长丁胜此前接受采访时指出,跟普通药物相比,基因治疗方式的前期研发有很高门槛,治疗基因的设计、优化乃至载体选择都不容易,而基因疗法的链条非常长,选择何种载体、何种片段的治疗基因、基因治疗过程中采用何种技术,每一个环节都需要根据患者的情况进行设计以及质检,才能保证安全,这就导致有些品种的药品难以批量化生产,生产成本居高不下。
美国对华发起新301调查,对中国造船业影响有多少?
此次301调查的政治性和经济性特点明显大于法律性,并可能改变全球造船业的生态环境和竞争条件。美国时间4月17日,美贸易代表办公室(USTR)宣布发起针对中国海事、物流和造船业的301调查。商务部新闻发言人表示,中方对此强烈不满,坚决反对。锤子财富2024-04-19 10:52:440000我国今年预计实施100次左右发射任务,有望创造新的纪录
2024年中国航天全年预计实施100次左右发射任务,有望创造新的纪录,我国首个商业航天发射场将迎来首次发射任务,多个卫星星座将加速组网建设。2月26日,航天科技集团发布《中国航天科技活动蓝皮书(2023年)》(简称《蓝皮书》)。《蓝皮书》显示,2024年中国航天全年预计实施100次左右发射任务,有望创造新的纪录,我国首个商业航天发射场将迎来首次发射任务,多个卫星星座将加速组网建设。0000下周关注丨11月PMI数据将公布,这些投资机会最靠谱
11月PMI数据将公布;中方将对法、德、意、荷、西、马六国试行单方免签;自动驾驶相关政策将施行;华为智选车智界S7将正式发布;首届中国国际供应链促进博览会将开幕。【重磅新闻】11月PMI数据将公布锤子财富2023-11-26 20:36:480000诺贝尔物理学奖授予阿秒激光 我国首个阿秒激光装置正在建设中
在我国,阿秒激光相关的研究被纳入国家重要发展方向,已经建成的相关实验系统及正在规划的科学装置,通过观察电子运动,成为未来时间分辨率范畴的最好“电镜”。锤子财富2023-10-03 21:53:050000多方合力精细治理,促进新就业形态健康发展︱法经兵言
针对新就业形态领域中所涌现的网约车市场饱和、直播主播涉税违法、外卖骑手权益保护、网络房地产经纪运营规制、职业探店人行为规范等问题所表现出的社会现象及背后的法律问题,都值得深入分析。0000