基因疗法有望根治遗传性耳聋?《柳叶刀》发布一项重大医学成果
基因疗法有望根治遗传性耳聋?
1月25日,全球医学顶刊《柳叶刀》发表了一篇由复旦大学附属眼耳鼻喉科医院(下称上海市五官科医院)团队领衔且题为《AAV1-hOTOF基因治疗常染色体隐性遗传性耳聋9:一项单臂研究》(AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial)的研究长文。
业内人士告诉第一财经,该研究属于全球首个遗传性耳聋基因治疗的临床试验研究,其意义在于证明了AAV1-hOTOF在OTOF基因突变所致耳聋患者临床治疗中的安全性和有效性,或将推进其他致聋基因药物的研发和临床应用。
数据显示,全球先天性耳聋患者约有2600万,其中60%与遗传因素相关,常染色体隐性遗传性耳聋9(autosomal recessive deafness 9,DFNB9)由OTOF基因突变导致,占遗传性耳聋的2%至8%,这类患者通常表现为重度、极重度或完全听力损失和言语障碍。临床上尚无治疗遗传性耳聋的药物。
AAV1-hOTOF基因治疗,是一种针对常染色体隐性遗传性耳聋9患者的创新型疗法。那么,究竟OTOF基因突变致聋的患者占比多少?上述研究中,AAV1-hOTOF基因治疗方案如何实施,结果如何?
“目前,全球已知致聋基因有150多个,OTOF是常见基因之一,尤其是在我国婴幼儿听神经病人群中,发病率高达41%左右;OTOF也正是我们此次临床试验的基因治疗靶点。”该项研究主导人员、上海市五官科医院主任医师舒易来教授在接受第一财经采访时表示。
根据研究方案,该单中心临床试验中,入选标准为患重度听力损失至全聋,并且OTOF两个等位基因均携带突变(年龄为1至18岁),排除标准为双侧人工耳蜗植入,或体内针对AAV1的中和抗体滴度>1:2000的患者。研究者经外耳道入路通过圆窗向受试者耳蜗内单次注射AAV1-hOTOF,将治疗后6周评估剂量限制性毒性作为主要结果,次要结果为有效性和其他安全性。最终,425名受试者被筛选,6名受试者被招募入组并接受AAV1-hOTOF基因治疗。
该研究结果显示,在26周的随访时间内,6位受试者均未出现剂量依赖毒性反应,AAV1-hOTOF基因治疗在随访期间展示了良好的安全性和耐受性;同时,5位受试者在接受治疗后听觉功能恢复,并且效果随着时间的增加而更明显。
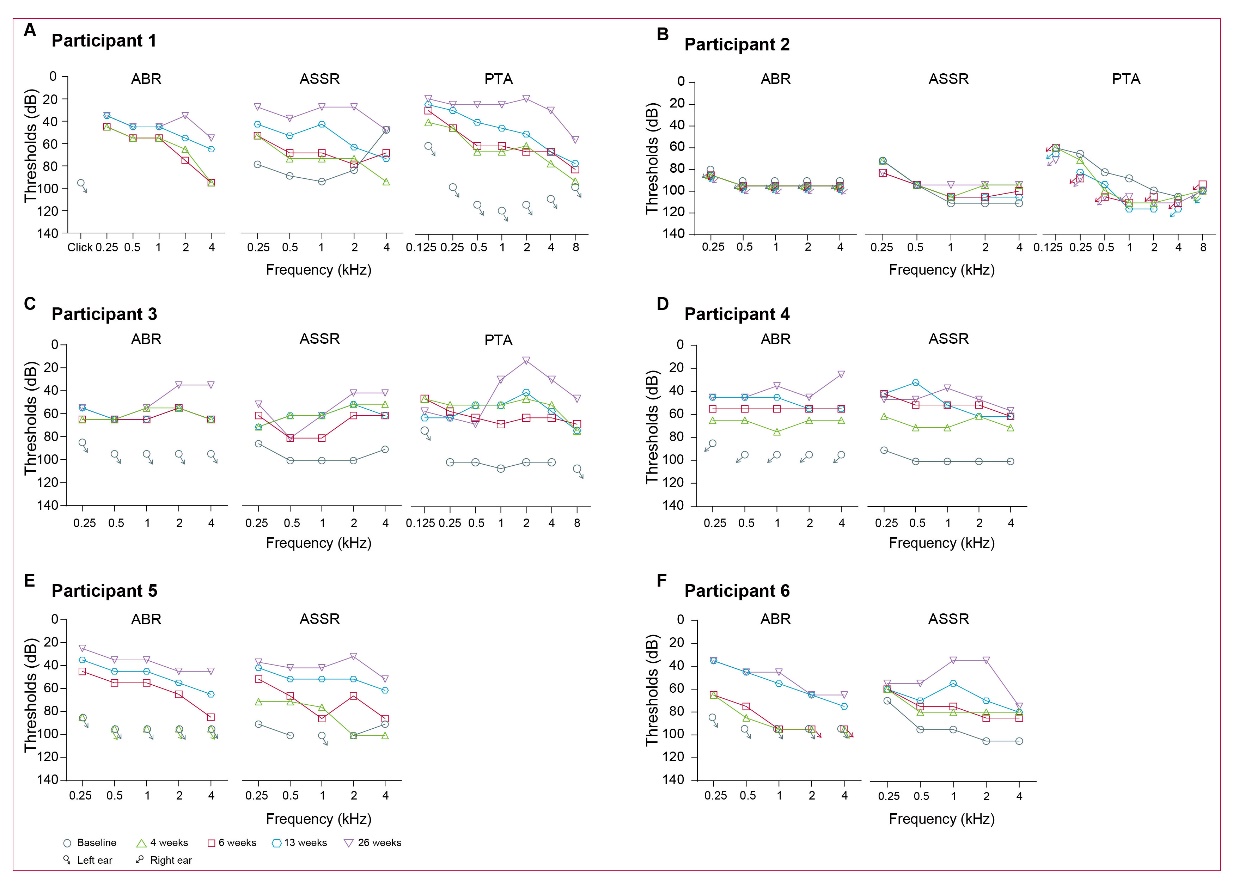
(图:AAV1-hOTOF基因治疗前后的受试者听力)
事实上,上述研究也被业内称为是全球第一项双AAV(腺相关病毒,adeno-associated virus)载体的人体试验。由于OTOF基因超出了单个AAV的装载容量,为了克服大基因内耳递送难题,研究团队利用AAV的双载体递送系统,即由2个AAV载体携带OTOF基因编码序列,在OTOF耳聋动物模型中表达具有正常功能的人源OTOF蛋白,显著改善了听力。
对于研究方案的安全性,舒易来教授为记者解释,腺相关病毒载体即AAV载体目前是基因治疗领域最常用的载体之一,且已经有多款AAV基因治疗药物上市。
“为尽可能避免AAV相关的风险,考虑到安全性,研究采取多种措施,包括:一方面,在血清型选择上,筛选并采用已经上市药物使用的AAV1载体,其已经在人体进行安全性验证;另一方面,采用内耳局部给药,并在临床前就进行了剂量效应探索,给药量只有30或50微升。此外,入组患者筛选上,将AAV1中和抗体浓度作为排除标准之一。而在治疗中及治疗后,我们会对AAV相关风险进行系统监控以及准备充分的预案。”舒易来教授说。
“这是一项非常‘聪明’的研究。”复旦大学上海医学院副院长朱同玉评价。
朱同玉院长向记者解释,一方面,此次研究选择的靶点非常“聪明”且关键,这在于研究所采用的基因疗法局部应用在了耳蜗内(神经递质较为集中且定点较为容易)而不是全身。另一方面,基因疗法所采用的“双载体“给药是很好的办法,多载体药物递送系统将是未来的趋势。
该基因疗法何时能够惠及患者?舒易来教授告诉记者,目前,团队正和具有丰富经验的基因治疗公司进行沟通,进一步优化系统进行转化,推动相关药物落地,“我们临床和研发的科研团队,会主要参与到临床前药物的研发、后续临床试验开展中去,尽快将药物推进至IND(新药临床研究审批,Investigational New Drug)申报,进行推广。”
发布会纪要丨上半年经济“成绩单”揭晓,下半年将如何走?统计局最新回应
国家统计局表示,上半年5%的经济增速是含金量比较高的速度;完全有信心、有条件也有能力完成全年经济社会发展预期目标任务。锤子财富2023-07-17 12:29:550000新冠疫苗7月15日起不再免费接种?多家医院这样回应
随着新冠流行常态化后,市场对新冠疫苗的需求大大减少。近日,有消息称,自2024年7月15日起,新冠病毒疫苗由免费接种调整为自费接种。第一财经记者从一些地区医院或者社区卫生服务中心求证到,近日确实有收到相关政策。“我们医院暂时没有新冠疫苗可以接种,但已收到通知,7月15日起,新冠疫苗将改为自费接种了。”广西壮族自治区河池市第三人民医院有工作人员这样表示。锤子财富2024-07-12 14:39:0900007月新冠重症新增病例连续两个月下降,疫苗还要打吗
相比6月份,7月份全国报告的新增新冠重症病例以及死亡病例分别环比减少了1513例,174例。中国疾控预防控制中心近日公布了7月份全国新型冠状病毒感染疫情情况,其中新冠重症病例数降低至五百例以下。锤子财富2023-08-05 12:16:260000商务部启动2024“中华美食荟”活动:首次设立“中华美食文化季”,深化餐饮业国际合作
传播中华传统美食文化,深化餐饮业国际合作,带动餐饮企业“走出去”。我国餐饮市场规模正稳步扩大,餐饮消费潜力进一步释放。据商务部网站消息,4月12日,商务部会同相关部门、山东省人民政府在济南市启动2024年“中华美食荟”活动,同期配套举办中华美食市集和农餐对接活动。锤子财富2024-04-13 11:22:020000谷歌开放全球英语广告商AI图像编辑功能,并与初创公司Typeface达成合作
谷歌近期宣布其人工智能图像编辑功能向全球英语母语广告商开放,并计划推出多语言版本,同时与Typeface合作探索AI在广告中的应用,以应对市场竞争和挑战。0001