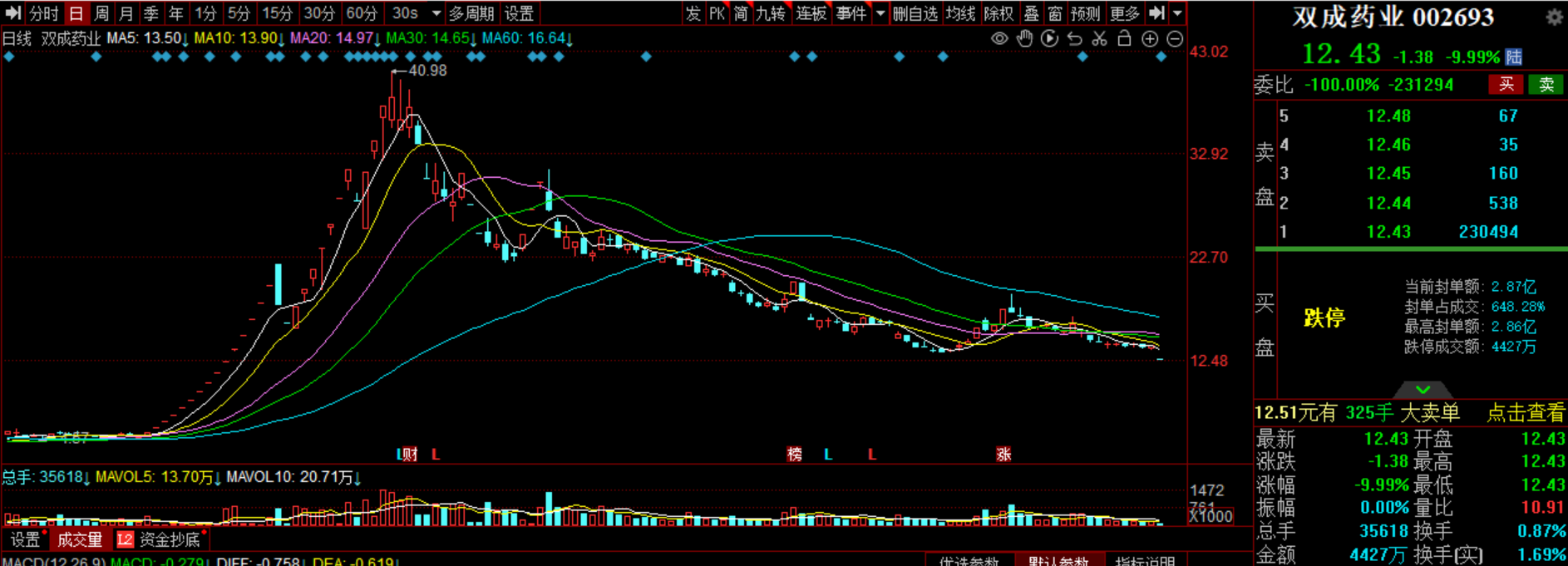
国产司美格鲁肽距离上市只差“临门一脚”?但商业化还面临这些难题
作为糖尿病和肥胖症的重要治疗药物,司美格鲁肽生物类似药的临床研发竞速在加快。
15日,华润双鹤公告称,近日,公司收到国家药监局签发的司美格鲁肽注射液《药物临床试验批准通知书》,司美格鲁肽注射液适用于成人2型糖尿病患者的血糖控制。
在后来者不断涌入的同时,率先开展仿制研发的国内药企已拉开商业化比拼的帷幕。国家药品监督管理局药品审评中心(CDE)官网信息显示,4月3日,九源基因递交的司美格鲁肽注射液"吉优泰"上市申请获得受理,这也是国内第一款申报上市的司美格鲁肽生物类似药。
最新数据显示,截至4月15日,共14家企业获得国家药监局临床试验批准,将司美格鲁肽注射液用于2型糖尿病相关适应症;该注射剂在体重管理适应症在国内尚未有进口及国产产品上市,但已有石药集团、丽珠集团、联邦制药、九源基因和翰宇药业等开启司美格鲁肽减重适应证的临床探索。
CIC灼识咨询董事总经理刘立鹤预测称,随着司美格鲁肽等更多GLP-1创新药以及生物类似药上市,预计2030年我国GLP-1的市场规模将超600亿元。
继PD-1抑制剂之后,国内生物药市场又将掀起新一轮"内卷"?
研发扎堆,上市期待定
除了九源基因,还有数家国内药企研发的司美格鲁肽类似药进入临床三期,距离上市只差"临门一脚"。
司美格鲁肽是一款由丹麦诺和诺德公司开发的一款用于一种长效3 人胰高血糖素样肽-1(GLP-1)受体激动剂。作为一款最初用于糖尿病患者血糖控制的"老药",它在2021年进入中国市场。同年,司美格鲁肽注射液在美国获批体重管理适应症,这让业界看到了更大的市场空间。
根据中国医药工业信息中心4月发布的《中国仿制药发展报告2023》,2023年,CDE受理的生物类似药创近4年新高,达69件,其中司美格鲁肽的申请数达21件,涉及7家公司。截至当年底,处于临床阶段的司美格鲁肽类似药在研企业数达到10家。
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。理论上,生物类似药具有明显的价格优势和与原研药相当的疗效。
但受制于专利壁垒,司美格鲁肽类似药的商业化进程存在较大的不确定性。
司美格鲁肽原研药的核心化合物专利在中国于2026年3月19日到期,此外诺和诺德还就相关制剂先后申请了多项外围专利,多项外围专利也未到期。
对于仿制药企而言,如果被仿制的相关专利已被纳入中国上市药品专利信息登记平台,按照药品专利纠纷早期解决机制实施办法,有两种解决路径:
其一,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;其二,中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
"我国对首个挑战专利成功并首个获批上市的仿制药,给予1年的市场独占期,市场独占期限内不再批准同品种仿制药上市。但直到今年才有一款仿制药以‘首仿获批 首个挑战专利成功’获得市场独占期。"一名医药知识产权纠纷律师对第一财经表示。
北京大成律师事务所合伙人陈福进一步对记者介绍说,药品专利链接制度旨在"激励新药研发"和"促进仿制药及时上市",平衡原研药企业和仿制药企业之间的利益。如果仿制药企在原研药专利保护期内进行商业化推广,涉嫌专利侵权。
陈福表示,由于生物药研发的复杂性,原研药企为更好保护自身利益,往往会在研发过程中进行专利布局,除了申请核心专利外,还会申请多项外围专利,延长创新药的保护期限。由于药品上市审批周期较长,为补偿新药上市审评审批占用的时间,可以给予专利权期限补偿(一般不超过五年)。换言之,即使原研药核心专利到期,也不意味着仿制药企一定能启动商业化。
以九源基因为例,其在研产品有望成为中国首款获批上市的司美格鲁肽类似药。2015年,九源基因对诺和诺德相关原研药的制剂专利(CN200480034152.8)提出"专利无效"请求,获得国家知识产权局专利复审委员会支持。随后诺沃挪第克公司(即诺和诺德)对国知局专利复审委员会提出行政起诉。2021年公开的二审判决书显示,北京高级人民法院维持原审判决,对诺和诺德的起诉不予支持。
但对于司美格鲁肽的核心化合物专利,九源基因并没有发起专利挑战。今年1月,九源基因向港交所提交了IPO申请,其招募书称,"除非有管辖权的法院最终裁定该专利无效,否则我们将无法在该专利到期之前将JY29-2(吉优泰)商业化。"
而另一家国内药企中美华东就司美格鲁肽的核心化合物专利向诺和诺德发起专利挑战,该争端问题尚未有定论。"目前,司美格鲁肽的国内市场已经打开,尤其原研药的减重相关适应证获批在即,诺和诺德在未来两年国内专利期内的利润空间还是非常可观的。所以,尽管原研药核心化合物的专利已经临期,但他们(诺和诺德)是不会放弃起诉的,目前最高法正在受理此案。"一名接近该起案件的业界人士对记者透露。
此外,随着多款国产GLP-1药物也在同步开展海外临床,陈福还提示说,美国等海外市场对原研药的保护制度较多(例如药品试验数据保护制度),专利保护力度大,其在海外上市时间可能还会拉长。
GLP-1靶点"内卷化"更甚PD-1?
相关数据显示,全球在研的GLP-1药物有100多款,其中近一半来自国内药企。有受访业界人士提出担忧:在资本助推下,GLP-1市场是否会再现以PD-1为代表的肿瘤药靶点扎堆、同质化创新的问题?
与泛癌种治疗药物PD-1类似的是,GLP-1在多个疾病市场表现出不错的治疗前景,已获批和潜在适应证覆盖患者人数多。
目前该靶点药物全球已获批适应证为针对糖尿病和肥胖的治疗。在糖尿病治疗方面,据相关大型流行病学调查数据,近30年来我国糖尿病患病率从0.67%增长至11.2%;在减重治疗方面,有研究显示,中国的肥胖患者数量预计在2030年将达到全球的26.8%。
除了针对糖尿病和肥胖治疗,GLP-1药物在心血管风险、糖尿病肾病、阿尔茨海默病、非酒精性脂肪性肝炎、外周动脉疾病等多种疾病领域也显示出适应证拓展的潜力。
根据nature预测,2024年,诺和诺德与GLP-1相关的三款药品(降糖针剂Ozempic,降糖片剂Rybelsus和减肥针剂Wegovy)合计销售额预计超过280亿美元,将替代K药(Keytruda,帕博利珠单抗)成为新一代"药王"。
庞大的存量和增量市场,让更多国内药企动了"分一杯羹"的念头。但与尚未纳入医保、单价万元的K药相比,司美格鲁肽针对糖尿病相关适应证已进入基本医保。根据国家医保局16日消息,2023年版国家医保药品目录收载3088种药品,涵盖了全国公立医院90%以上的用药份额,其中属于胰高血糖素样肽-1(GLP-1)受体激动剂的降糖药就有7种,包括司美格鲁肽注射剂。
与此同时,在减重的自费市场,国内生物类似药也即将与原研药同台竞技。诺和诺德在今年早些时候官宣,其明星减肥药 Wegovy 预计今年获批在中国上市销售,但数量有限,最初将主要针对自费患者群体。
刘立鹤认为,作为当前的热点方向,GLP-1药物已然受到来自国内外生物制药企业的重点关注和投入,最终的结果可能将从"创新战"变成"成本战"。
"作为降糖和减重药物,GLP-1药物具有明确的量化指标,因此最终可能会出现疗效、性价比、依从性等方面最具优势的几家企业脱颖而出,成为市场的主导者。但对大多数企业来说,这种内卷竞争可能带来一定的压力,甚至有可能经历生存考验。"刘立鹤说。
国家药监局官网近日发布《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则(征求意见稿)》,拟要求相关生物类似药临床安全有效性比对试验需选择不合并2型糖尿病的中国肥胖人群,与原研药进行一项临床等效比对研究。
记者注意到,该征求意见稿在2023年11月就起草并形成初稿。CDE方面在起草说明中称,已注意到"司美格鲁肽注射液生物类似药体重管理适应症是当前研发热点"。
特斯拉召回部分进口及国产Model 3、Model Y汽车 共计110.46万辆
自5月29日起,召回生产日期在2019年1月12日至2023年4月24日期间的部分进口ModelS、ModelX、Model3及国产Model3、ModelY汽车,共计1104622辆。0000证监会发布会要点汇总:巩固深化常态化退市机制,坚决防止“一退了之”
郭瑞明表示,我们也关注到市场上“A股退市率不高”的观点。退市改革的核心是坚持“应退尽退”,在退得下的同时还要退得稳,也并不是退得越多越好。1月19日,证监会召开例行发布会,以下是发布会要点汇总:坚决防止“一退了之”,公司及相关方违法违规的,即使退市也要坚决追责证监会上市司司长郭瑞明表示,证监会下一步将持续巩固深化常态化退市机制。0000推进长三角一体化高质量发展,要抓住这几个战略重点
深入推进长三角一体化发展,要紧扣一体化和高质量这两个关键词。长三角一体化发展在国家战略全局发挥着重要作用,三省一市要以战略思维和全球视野来认识一体化发展问题,一任接着一任干,谱写一体化发展的新篇章。把握一体化和高质量两个关键词深入推进长三角一体化发展,要紧扣一体化和高质量这两个关键词。0000俄罗斯外交部召见美国驻俄大使
俄新社援引俄罗斯联邦安全局今年8月公布的消息报道称,一名美国驻符拉迪沃斯托克总领馆的前工作人员曾按照这两名外交官的指令搜集有关特别军事行动及俄罗斯动员情况的信息。当地时间9月14日,俄罗斯外交部召见了美国驻俄大使,并向其递交了照会,认为美国驻俄使馆一秘和二秘的行为与外交人员身份不符,认为两人为不受欢迎的人,应在七天内离境。0000习近平在全国科技大会、国家科学技术奖励大会、两院院士大会上的讲话(全文)
针对集成电路、工业母机、基础软件、先进材料、科研仪器、核心种源等瓶颈制约,加大技术研发力度,为确保重要产业链供应链自主安全可控提供科技支撑。在全国科技大会、国家科学技术奖励大会、两院院士大会上的讲话(2024年6月24日)习近平各位院士,同志们、朋友们:0001